「水温 水量 とける量」+αで解く溶解度計算

【解説】
|
水温(℃) |
0 |
20 |
40 |
60 |
80 |
100 |
|
ホウ酸(g) |
2.8 |
4.9 |
8.9 |
14.9 |
23.5 |
38.0 |
「100gって書いてあるし、温度を60℃から20℃に下げるので、
14.9 − 4.9 = 10g が答え」・・・ではありません!
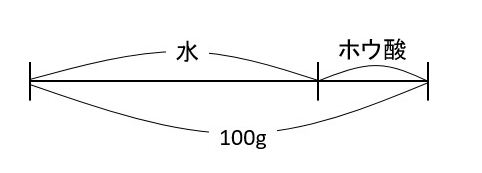
「水の量が100gであれば答えはそれでいいのですが、問題は「飽和水溶液(とけるだけとかした液)が100g」ですから、水とホウ酸をあわせた重さが100g(下の図の状態)なんですね。
なので、上の図のように、水は100gより少ないんです。
さて、「もののとけ方」の問題ですから、
「計算系の問題が苦手でも混乱せずに解ける 溶解度計算の整理のポイント」
でもお伝えしましたが、やはり「鉄則」どおり「水温 水量 とける量」で書き出しです。
ただし今回は「飽和水溶液(とけるだけとかした液)が100g」ですから、「水溶液全体の重さ」も書き出しに加えましょう。
水温 水量 とける量 全体
60℃ 100g 14.9g 114.9g
↓とけのこり 14.9 – 4.9 = 10g
20℃ 100g 4.9g
水が100g、つまり飽和水溶液全体が114.9gのとき、温度を下げると10gのとけのこりが出ます。
今考えたいのは、飽和水溶液全体が100gのときのとけ残りの重さ。
だから
10 × ![]() =
= ![]() = 8.70 ・・・ よって 答えは8.7g となります。
= 8.70 ・・・ よって 答えは8.7g となります。
このように、「もののとけ方」の問題では「水の重さをくらべる」だけでなく「水溶液全体の重さをくらべる」問題も出てくることを覚えておきましょう。
難関校では頻出です!